مقدمه
پروتئومیکس مطالعه در مقیاس گسترده پروتئین ها می باشد. پروتئین ها با دارا بودن انواع مختلف عملکردها اجزای اساسی سلول ها می باشند. در واقع اصطلاح پروتئومیکس در سال 1997 بعد از مطرح شدن ژنومیکس بوجود آمد. پروتئوم کلیه پروتئین های تولید شده و تغییر یافته توسط یک ارگانیسم می باشند. پروتئومیکس یک ناحیه بین رشته ای می باشد که از اطلاعات ژنتیکی پروژه ژنوم انسان استفاده های زیادی کرده است.
بعد از ژنومیکس و ترانسکریپتومیکس ، پروتئومیکس گام بعدی جهت مطالعه سیستم های بیولوژیک می باشد. در اینجا ژیچیدگی مطالعات بسیار بیشتر از ژنومیکس می باشد، زیرا ژنوم یک ارگانیسم پایدار و با ثبات می باشد. اما پروتئوم از یک سلول به سلول دیگر و حتی از یک زمان به زمان دیگر در یک سلول متفاوت می باشد. قبلا جهت بررسی پروتئوم از آنالیز RNA استفاده می شد، اما معملوم شد که این نمی تواند با محتویات پروتئینی موجود همبستگی داشته باشد. امروزه معلوم شده که همیشه mRNA به پروتئین ترجمه نمی شود و میزان ترجمه آن به پروتئین بسته به ژن رونویسی شده و نیز شرایط فیزیولوژیک آن سلول دارد. پروتئومیکس دقیق ترین تکنیک جهت بررسی میزان پروتئین موجود در سلول می باشد.
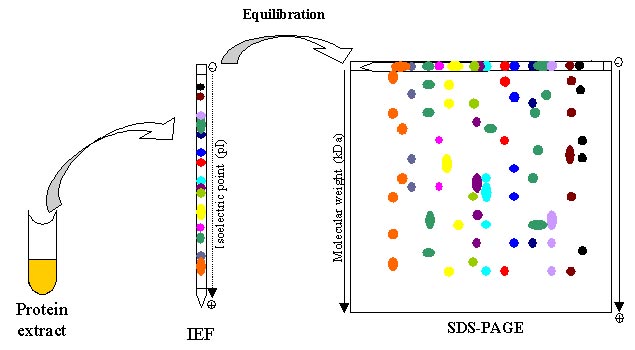
به منظور بررسی پروتئوم موجودات زنده لازم است که پروتئوم آنها ابتدا خالص گردند. در واقع اولین مطالعات بر روی پروتئین ها با ابداع ژل دو بعدی در سال 1975 ، بر روی پروتئوم باکتری اکلای توسط اوفارل صورت گرفت. در واقع ژل الکتروفورز دو بعدی جزو اصلی تکنیک پروتئومیکس می باشد. الکتروفورز دو بعدی نوعی ژل الکتروفورز می باشد که جهت آنالیز پروتئین ها به کار برده می شود. در این تکنیک مخلوط پروتئینی با استفاده از دو ویژگی در ژل دو بعدی جدا می شود.
اصول تکنیک الکتروفورز دو بعدی
در الکتروفورز دو بعدی ابتدا بعد اول ران می شود و سپس به صورت عمود بر بعد اول مولکولها در بعد دوم ران می شوند تا یک الکتروفورگرام در بعد دوم شکل بگیرد. در بعد اول الکتروفورز ، پروتئین ها بر اساس نقطه ایزوالکتریکشان به صورت خطی جدا می شوند. در بعد دوم ، مولکول ها با 90 درجه تفاوت نسبت به بعد اول بر اساس وزن مولکولی شان جدا میشوند. از انجایی که دو مولکول به احتمال بسیار بسیار پایین در این دو ویژگی (نقطه ایزوالکتریک و وزن مولکولی) مشابع می باشند، مولکول ها با کیفیت بسیار بالاتری در الکتروفورز دو بعدی نسبت به الکتروفورز 1 بعدی جدا می شوند.
بعد اول این تکنیک را تکینیک الکتروفورز تمرکز ایزوالکتریک (IEF) گویند. در این روش یک گرادیان PHی برای ژل ایجاد می شود و یک طرف ژل نسبت به طرف دیگر آن مثبت تر می باشد. بعد دوم این تکنیک شامل SDS-PAGE در سیستم بافری ناپیوسته می باشد که در آن پروتئین ها با توجه به تفاوت وزن مولکولی تفکیک می گردند.
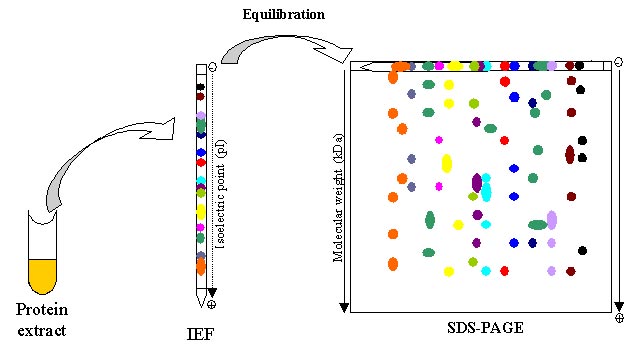
شکل 1) مراحل الکترروفورز دو بعدی
اگرچه الکتروفورز دو بعدی در ابتدا به هدف جداسازی تمام یا اکثر اجزای یک نمونه پروتئینی همچون عصاره سلول ها صورت گرفت، اما هر روزه کاربرد آن بیشتر می شود. مطالعه تنظیم بیان ژن ها و اثر شرایط مختلف بر تولید پروتئین ها در سلول، مقایسه فسفوریلاسیون پروتئین ها در سلول و حتی خالص سازی پروتئین ها به اهداف مختلف (مثل تعیین توالی اسیدهای آمینه) از دیگر موارد کاربرد این روش است.
آماده سازی نمونه
نتیجه مطلوب و جداسازی کامل اجزای نمونه در الکتروفورز دو بعدی تا حد زیادی وابسته به کارایی ایزوالکتریک فوکوسینگ می باشد که الکتروفورز بعد اول را تشکیل می دهد. در این روش بر خلاف SDS-PAGE نمی توان برای استخراج و یا محلول سازی نمونه، آن را در بافر حاوی سدیم دودسیل سولفات جوشاند. زیرا SDS با اتصال به پروتئین ها باعث تغییر در بار الکتریکی آنها می شود.
نمونه های پروتئین در IEF شامل مایعات بیولوژیک همچون سرم یا پلاسما، بافت های جانوری یا گیاهی و سوسپانسیون های سلولی همچون گلبول های خون و یا کشت سلول است. نمونه های مایع معمولا مشکل محلول سازی کمتری دارند و با تیمار ساده تری می توان آنها را الکتروفورز و تفیکیک نمود. بعضی از این محلول ها ، همانند سرم و پلاسما دارای غلظت بالایی از پروتئین هستند و قبل از استفاده باید رقیق گردند. محتوای بالای آلبومین و گاماگلوبولین سرم و پلاسما باعث می شود این پروتئین ها منقطه وسیعی را به خود اختصاص دهند و تعدادی از پروتئین های دیگر را بپوشانند.
برای آماده نمودن بافت های جامد بایستی آنها را در یک بافر مناسب هموژن کرد. سپس عصاره آنها را با کمک سانتریفیوژ با دور بالا صاف کرد. شرایط آماده سازی این بافت ها باید با حداقل تغییرات در پروتئین ها همراه باشد. برای هضم زمینه بافت و دسترسی ساده تر به پروتئین ها نمی توان این بافت ها را تحت تاثیر آنزیم های پروتئاز قرار داد. به منظور جلوگیری از فعالیت پروتئازها باید از مهارکننده هایی مانند PMSF استفاده کرد. در صورتی که غلظت اسیدهای نوکلئیک در نمونه بالا می باشد، می توان از آنزیم های نوکلئاز جهت هضم آنها استفاده کرد.
بافر حل کننده نمونه بایستی بتواند تمام پیوندهای غیر کوالان را در پروتئین های چند واحدی و تجمعات پروتئینی حذف نماید. این موضوع مخصوصا در مورد پروتئین های آب گریز که میل تجمع یافتن در آنها شدید است، اهمیت دارد. وجود این کمپلکس های پروتئینی مقاوم در نمونه ، باعث پیدایش نقاط جدیدی در الگوی الکتروفورزی می گردد که ممکن است تفسیر نتایج را مشکل کند. معمول ترین روش محلول سازی که ابتدا توسط اوفارل مطرح گردید، حل کردن نمونه در محلول حاوی دترجنت NP-40 4 درصد وزنی –حجمی ، اوره 9.5 مولار، آمفولیت 2 درصد و DTT یک درصد است. این روش در محلول نمودن بسیاری از نمونه های پروتئینی نتیجه خوبی دارد. با این حال نمی توان بعضی نمونه های پروتئینی را به طور کامل حل کرد. در بسیاری از موارد می توان به جای NP-40 از CHAPS که یک دترجنت آمفوتری است، برای حل نمودن پروتئین ها استفاده کرد. CHAPS جهت حل نمودن پروتئین های غشایی که آبگریز می باشند ارجهیت دارد. SDS نیز جهت حل کردن نمونه های پروتئینی مناسب است، اما به دلیل یونی بودن ، نمی توان از آن در IEF استفاده کرد. اگر در مواردی استفاده از SDS ضروری است، باید قبل از استفاده آن را با یک دترجنت بی بار مانند NP-40 رقیق یا جایگزین نمود.